19Behandlingen av både akutt og kronisk pankreatitt er hovedsakelig konservativ og ikke-invasiv, men endoskopisk behandling har de senere år etablert seg som en stadig viktigere del av det terapeutiske arsenalet. Jeg vil i denne oversikten belyse noen problemstillinger hvor endoskopisk behandling spiller en viktig rolle. Pasientgruppen er krevende på mange måter. Klinisk totalsituasjon og den endoskopiske behandlingen ved både akutt alvorlig pankreatitt og kronisk pankreatitt kan være komplisert og pasientene anbefales håndtert i et multidisiplinært team med erfaring i vurdering og behandling av tilstandene.
I. Akutt pankreatitt
Akutt pankreatitt er i stor grad en selvbegrensende tilstand som sjelden krever invasiv intervensjon med mindre det oppstår spesifikke, alvorlige komplikasjoner. Behandlingsmålet er å støtte pasienten gjennom den inflammatoriske fasen med fokus på tidlig adekvat rehydrering med intravenøs væske, tilstrekkelig smertelindring, ernæringsstøtte og behandling av evt. organsvikt.
Gallestenspankreatitt
Ved akutt pankreatitt er endoskopisk intervensjon ikke indisert i den tidlige fasen, med ett viktig unntak: gallesteinsindusert pankreatitt som er komplisert med kolangitt eller vedvarende «betydelig» gallegangsobstruksjon. Disse pasientene bør avlastes med ERCP i løpet av 1-3 døgn avhengig av klinikk. For andre pasienter med gallesteinsutløst pankreatitt kan intervensjon utsettes til pasienten er klinisk stabil. Et viktig og ufravikelig prinsipp er at gallestenspankreatitt skal ha forbyggende invasiv behandling før utskrivelse fra sykehus, fortrinnsvis cholecystectomi, alternativt ERCP med papillotomi.
Behandling av walled off nekroser (WON)
Akutt pankreatitt har et alvorlig forløp hos ca. 20 % av pasientene med utvikling av pankreatiske og/eller peripankreatiske nekroser (nekrotiserende pankreatitt) og truende multiorgan affeksjon. Disse pasientene kan ha et langtrukkent forløp med uker og måneder på sykehus. Forløpet er typisk 2-faset hvor den første uken (tidlige fase) er preget av systemisk inflammatorisk responssyndrom (SIRS) og organsvikt, etterfulgt av en sen fase (etter 1-2 uker) der komplikasjoner kan oppstå som følge av infeksjon i nekrotisk vev, kompresjon/obstruksjon av gallegang og/eller GI tractus, pseudoaneurismer, lekkasje fra pankreasgang, m.m. I den sene fase vil nekrosene gradvis innkapsles i lokulamenter kjent som WON, og hos ca. 50 % av pasienten vil disse kreve invasiv behandling. Behandlingen av WON har gjennomgått en revolusjon de senere år hvor man nå ikke intervenerer mer enn nødvendig og så sent som mulig ut fra det kliniske bildet («step-up» strategi). Endoskopisk transmural drenasje har blitt standard behandling og første valg fremfor tradisjonell kirurgisk drenasje. Indikasjoner for endoskopisk drenasje er de samme som for kirurgisk drenasje: mistenkt infiserte nekroser (vanligste indikasjon), obstruksjon/kompresjon av GI tractus/gallegang eller manglende klinisk bedring i senforløpet («failure to thrive»). Som hovedregel må man vente til nekrosene er demarkert (synlig kapsel på CT) og man har en etablert WON, det vil si minst 3-4 uker eller senere ut i forløpet. Gode CT bilder og/eller MR bilder (helst < 1 uke gamle) er viktig for å få informasjon om størrelse og utbredelse av WON, andel nekroser i kaviteten, avstand fra ventrikkel (duodenum), pseudoaneurismer og eventuelle større blodkar (f.eks. miltkarene) i relasjon til kaviteten samt tilstedeværelse av gastriske varicer, både med tanke på risiko i relasjon til prosedyren og risiko for et mer langvarig forløp hvor det bl.a. kan bli behov for nekrosektomi. Endoskopisk drenasje bør bare gjøres dersom multidisiplinært team er tilgjengelig (endoskopør, gastrokirurg, intervensjonsradiolog og anestesiolog) både med tanke på indikasjonsstilling og håndtering av eventuelle komplikasjoner i forløpet.
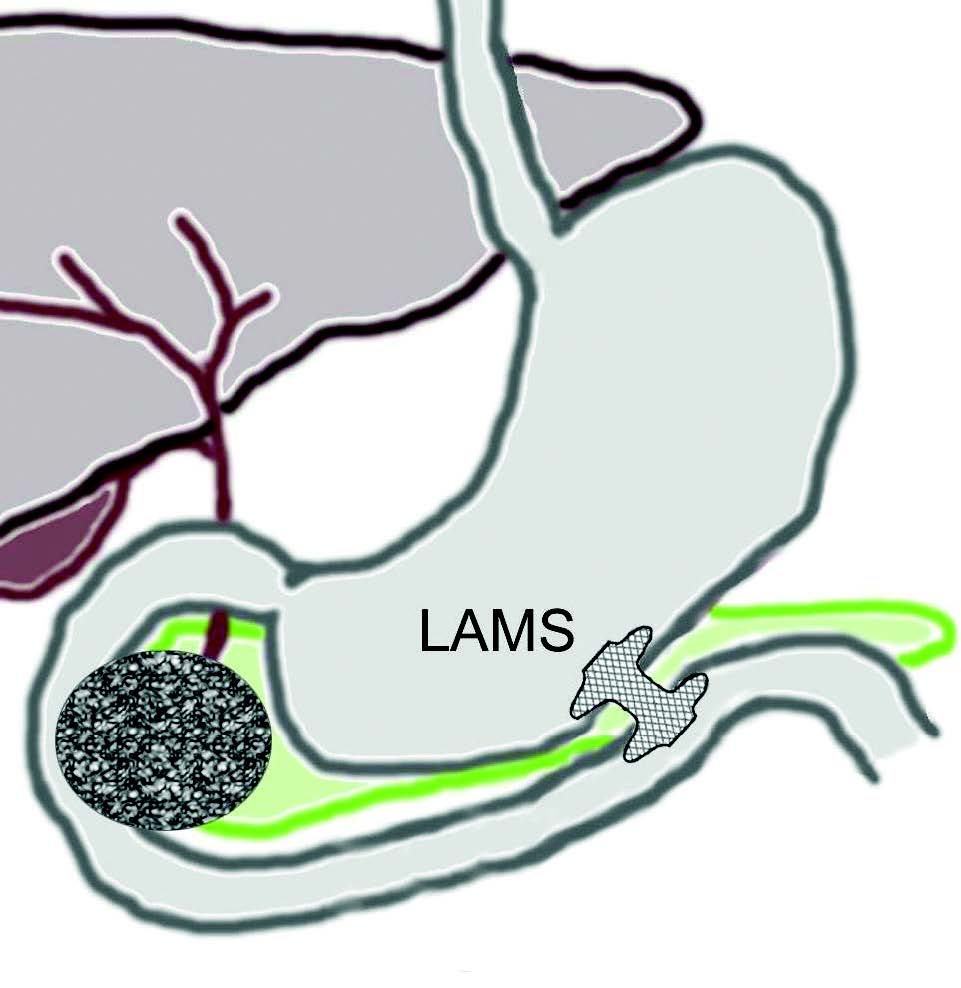
Samtidig med dreiningen mot primær endoskopisk behandling av infiserte nekroser har det blitt utviklet en helt ny type dekkede selvekspanderende metallstenter, såkalte «lumen apposing» metallstenter (LAMS). Stentene legges EUS veiledet og lager en kommunikasjon mellom ventrikkel (eventuelt tarm) og WON, en cystogastrostomi (Fig 1). Stentene har stor diameter (15-20 mm) og man oppnår på den måten god drenasje av nekrotisk materiale til ventrikkel. I tillegg får man tilgang til kaviteten med et gastroskop og dermed mulighet for uthenting av nekrotisk materiale (direkte endoskopisk nekrosektomi) dersom dette skulle bli nødvendig. I motsetning til eksterne kirurgiske dren er behandling med slike stenter smertefritt for pasienten.
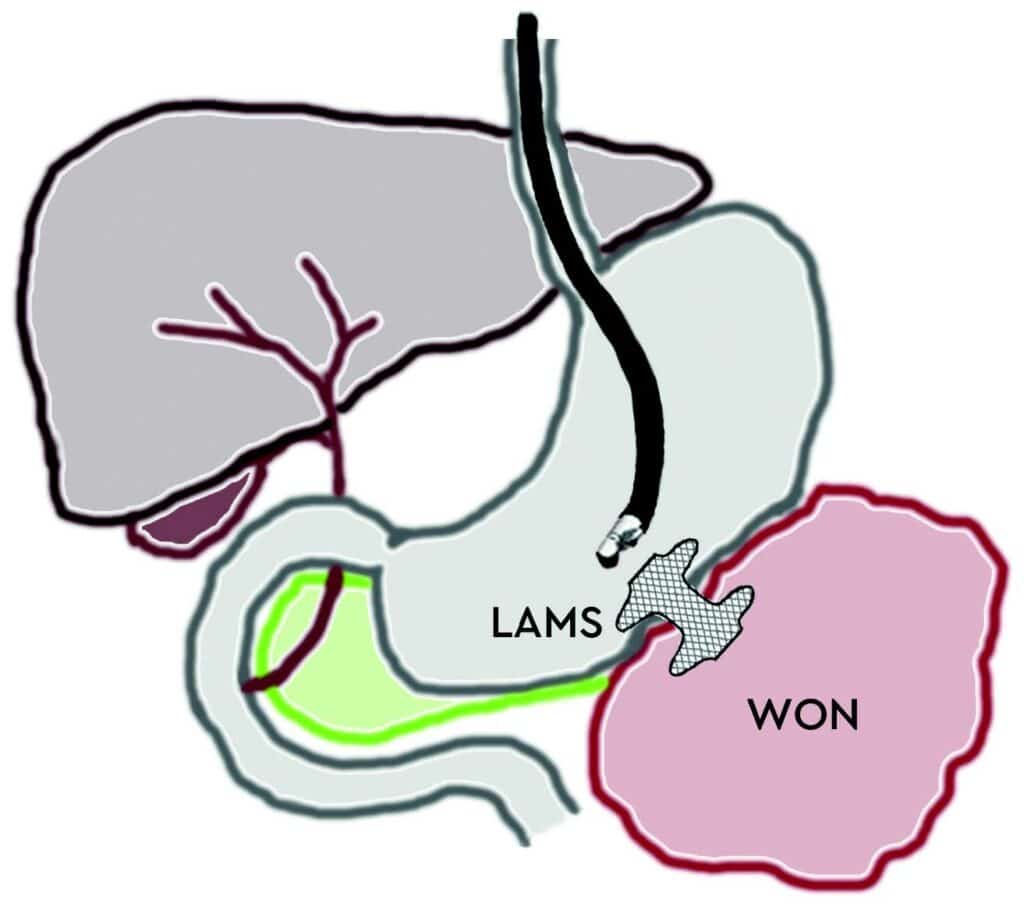
Fig 1: Illustrasjon av EUS-veiledet drenasje av WON til ventrikkel ved hjelp av «lumen apposing» selvekspanderende metall stent (LAMS).
Endoskopisk behandling er som nevnt førstelinjebehandling og bør uansett forsøkes først dersom teknisk mulig da ekstern drenasje av væskefasen og eventuell tilførsel av luft i WON kan vanskeliggjøre senere endoskopisk behandling. Tilhelingstid er normalt 4-6 uker avhengig av størrelse, utbredelse og andel faste nekroser i kaviteten, men kan hos enkelte pasienter være betydelig lenger. Stenten (LAMS) fjernes når kaviteten er borte (Fig 2).
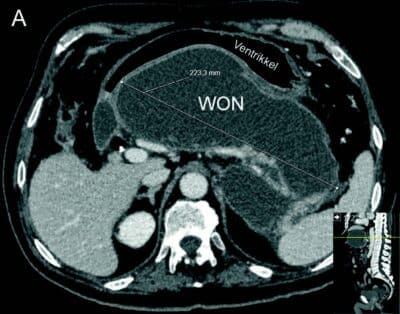
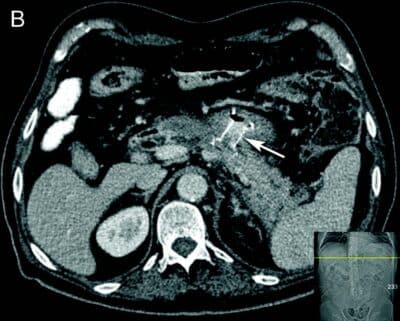
- Fig 2: CT bilder fra pasient med nekrotiserende pankreatitt og behandlingstrengende WON før drenasje (A) og 4 uker etter (B) innleggelse av LAMS (pil).
- Fig 2: CT bilder fra pasient med nekrotiserende pankreatitt og behandlingstrengende WON før drenasje (A) og 4 uker etter (B) innleggelse av LAMS (pil).
Pseudocyste og disconnected duct
I senfasen av akutt alvorlig pankreatitt vil væskeansamlinger på grunn av ødem og lekkasje fra pankreasgang kunne kapsles inn med en fibrøs vegg i en såkalt pseudocyste. Dette er altså ikke det samme som WON som er innkapsling av nekrotisk materiale, og innholdet i en pseudocyste er tyntflytende med høyt innhold av amylase. Utviklingen av pseudocyster skjer vanligvis etter noen uker, når den akutte inflammatoriske responsen har avtatt. Mange pasienter er asymptomatiske, spesielt hvis cysten er liten, og de fleste cyster vil gå tilbake spontant. Intervensjon er kun indisert dersom cysten gir symptomer eller komplikasjoner som blødning, ruptur eller infeksjon. Symptomer skyldes ofte masseeffekt, slik som kroniske magesmerter, kvalme, oppkast eller tidlig metthetsfølelse som følge av kompresjon av nærliggende organer som duodenum eller magesekken. Pseudocyster kan dreneres EUS-veiledet til ventrikkel, enten med dobbel pigtail stenter eller LAMS. Disconnected duct syndrome er definert som en komplett diskontinuitet i pankreas hovedgang, oftest i collum/corpus, og fører til et mer langvarig og komplisert forløp. Den frakoblede pankreasresten (cauda) opprettholder sin funksjon og produserer pankreassaft som ikke lenger kan dreneres gjennom pankreasgangen, men i stedet lekker ut i det peripankreatiske rommet og innkapsles som en pseudocyste eller danner fistler som kan være komplisert å behandle. I slike tilfeller kreves langvarig drenasje (> 6 mnd.) og EUS veiledet drenasje til ventrikkel er første valg. Transpapillær drenasje og «bridging» av defekten er teknisk svært vanskelig og lykkes sjelden som behandling alene. Dersom skaden ikke er for omfattende (inkomplett diskontinuitet) kan kontinuitet i pankreas hovedgang gjenopprettes med tiden, også uten at pankreasgang er stentet. Kirurgisk behandling er et alternativ dersom man ikke kommer til målet med endoskopisk intervensjon.
Vaskulære komplikasjoner
Arterielle pseudoaneurismer oppstår hos inntil 10 % av pasientene i forløpet av nekrotiserende pankreatitt som følge av at enzymatisk skade (pankreasenzymer eller infeksjon) på arterieveggen eller skade under invasive (kirurgiske, endoskopiske) inngrep. Dette fører til svekkelse og risiko for ruptur av arterieveggen. Miltarterien eller a. gastroduodenale er oftest affisert. Diagnose stilles på CT, men de kan være vanskelig å oppdage da det kan være begrenset sirkulasjon/kontrast i aneurismet, spesielt ved nylig blødning. Pseudoaneurismer i relasjon til WON eller pseudocyster må coiles før en eventuell endoskopisk drenasje av disse da ruptur av aneurismet kan føre til massive blødninger i etterkant av den endoskopiske drenasjen.
Ved akutt pankreatitt kan kompresjon/obstruksjon og/eller de inflammatoriske forandringene skade splankniske vener, spesielt miltvenen, og føre til trombose. Risiko øker med alvorlighetsgrad av pankreatitten. Ved miltvenetrombose vil ca. halvparten danne gastriske varicer lokalisert i fundus/cardia (Fig 3). Ruptur av varicene kan føre til svært alvorlige blødninger og forekommer hos ca. 7 % av pasienter med slike varicer. Blødende gastriske varicer behandles vanligvis endoskopisk med injeksjon av vevslim (histoacryl) i varicen. Alternativ kan man injiseres en kombinasjon av coiler og lim EUS veiledet i varicene, men denne teknikken er foreløpig lite utbredt. Begge metoder krever erfaring fra både endoskopør og assistenter. Ved manglende endoskopisk ekspertise tilgjengelig kan blødningen midlertidig kontrolleres med ventrikkelballongen på en Sengstaken sonde. Endoskopisk terapi som primærprofylakse mot blødning er oftest ikke indisert.
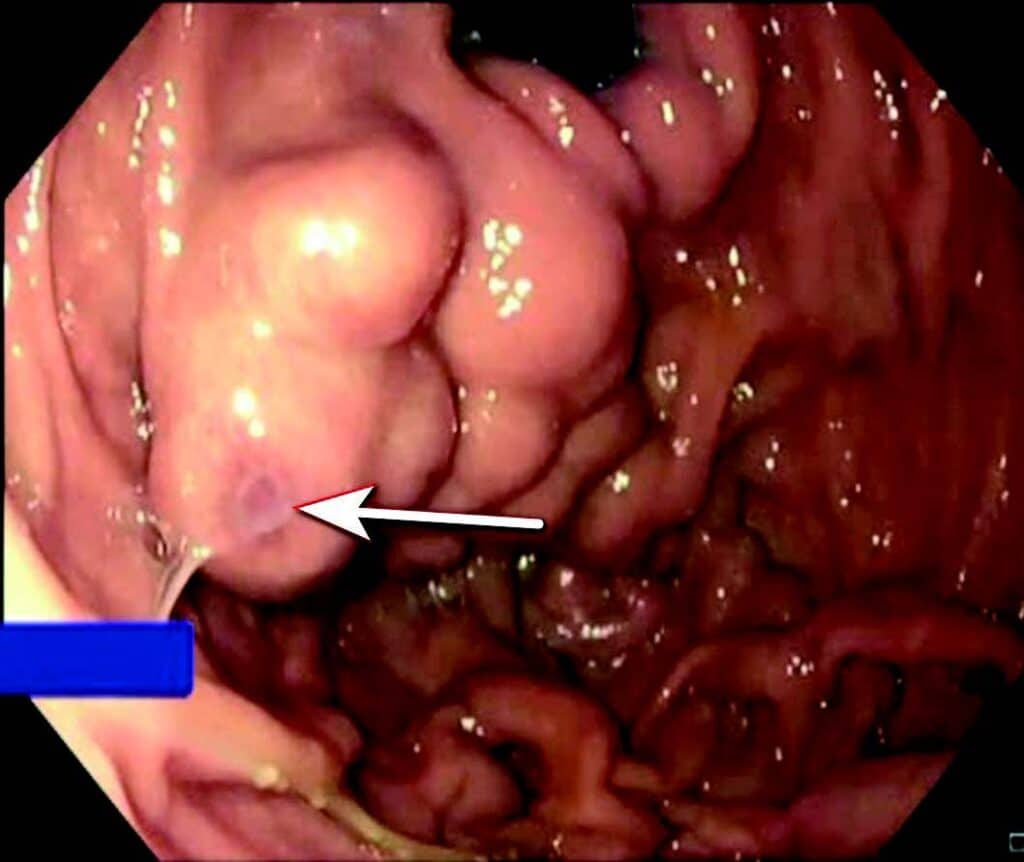
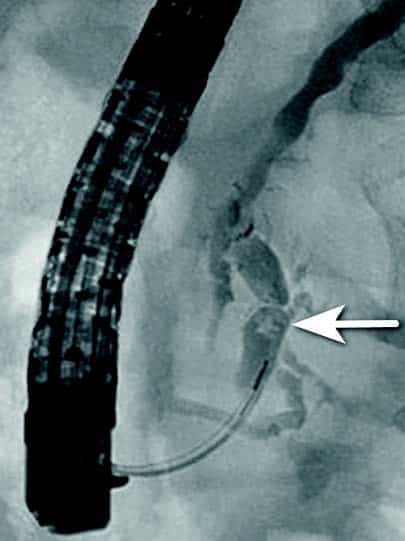
Fig 3: Gastrisk varice («fundusvarice») hos pasient med miltvenetrombose før endoskopisk liming. Blødning ble midlertidig stanset med Sengstaken sonde og blødningspunktet (fibrinplugg) på varicen er markert med pil.
II. Kronisk pankreatitt
Kronisk pankreatitt er en progressiv og irreversibel tilstand. Den er preget av vedvarende inflammasjon som gradvis erstatter pankreasparenkymet med fibrøst bindevev, ofte ledsaget av dannelse av konkrementer (kalknedslag) og strikturer i pankreasgangen. Livsstilsendringer med total avholdenhet fra alkohol og røykeslutt er viktig for å bremse sykdomsprogresjonen. Smerteterapi følger den tradisjonelle smertetrappen for kroniske smerter, og enzymtilskudd brukes liberalt for å hindre malabsorpsjon og symptomer som steatoré og vekttap ved eksokrin pankreasinsuffisiens. Intervensjon er primært rettet mot å lindre vedvarende symptomer, først og fremst smerter, dersom man ikke kommer til målet med konservative tiltak. Effekten av invasive tiltak er avhengig av at man kommer relativt tidlig til i forløpet. Langtkommen sykdom og spesielt opiatavhengighet > 6 mnd. gir mindre sannsynlighet for tilstrekkelig smertelindring. Avholdenhet fra alkohol og tobakk er også svært avgjørende. Pasientene har økt dødelighet, dels på grunn av komorbiditet, dels på grunn av risiko for pankreascancer.
Obstruksjon av pankreas hovedgang
Årsaken til smerter ved kronisk pankreatitt er multifaktoriell men kan hos mange, spesielt i tidlig fase av tilstanden (før pasienten blir opiatavhengig), forklares helt eller delvis av økt trykk i pankreas hovedgang på grunn av obstruksjon av fløde av pankreassaft. Obstruksjonen er oftest forårsaket av strikturer og konkrementer i caput eller collum og gir dilatasjon av hovedgangen. Obstruksjon lenger oppstrøms i corpus og cauda har sjeldnere klinisk relevans. Den vanlige og minst invasive tilnærmingen er å plassere en plaststent forbi obstruksjonen i hovedgangen som trykkavlastning for å se om dette bedrer smertene. Dersom effekt kan man fortsette stentbehandling og evt. gå videre med andre invasive tiltak. ESGEs retningslinje fra 2018 foreslår endoskopisk terapi og/ eller ekstrakorporal sjokkbølge-litotripsi (ESWL) som førstevalg for smertefull, kronisk pankreatitt med obstruerende konkrement og dilatasjon av hovedgang i caput eller corpus. Imidlertid viste ESCAPE-studien fra 2020 og en senere langtids oppfølgingsstudie at tidlig (opiatavhengighet < 6 mnd.) kirurgi var bedre enn endoskopisk behandling i å gi smertelindring både på kort og lang sikt. Pasienter operert tidlig hadde også mindre reintervensjoner enn pasientene med endoskopisk behandling. Nyere retningslinjer fra ASGE (2024) anbefaler derfor tidlig MDT vurdering med tanke på kirurgi. Det er imidlertid mange faktorer som påvirker valg av terapi, inklusiv pasientens ønske, komorbiditet og alder, og all invasiv (endoskopi/kirurgi) behandling har dårligere effekt jo lenger ut i sykdomsforløpet man har kommet. Tidspunkt for intervensjon kan være like viktig som valg av prosedyre, og beslutning om valg av terapi krever ekspertise og nøye risikovurdering i hvert enkelt tilfelle. All endoskopisk intervensjon på pankreas er beheftet med komplikasjoner som post-ERCP pankreatitt, blødninger, perforasjon og infeksjon. Pasienter med kronisk pankreatitt har dessuten økt risiko for adenocarcinom i pankreas som er en viktig differensialdiagnose ved dilatasjon av pankreas hovedgang eller forverring av symptomer hos pasienter med kronisk pankreatitt.
Små konkrementer i pankreas hovedgang (< 5 mm) kan ofte fjernes endoskopisk ved at strikturer dilateres og konkrementet hentes ut med konvensjonelle metoder (Fig 4). Større konkrementer er mer krevende og kan behandles med ESWL eller pankreatikoskopi og fragmentering av konkrement(ene) med sjokkbølgelitotripsi eller laser. Selv om man tilsynelatende klarer å fjerne alle konkrementer fra hovedgangen er tilbakefallsfrekvensen høy og pasientene risikerer langvarig stentbehandling (vanligvis en eller flere plaststenter) og gjentatte endoskopiske prosedyrer.
Den mest fornuftige behandlingsalgoritmen synes å være en «step-up»-tilnærming, der endoskopisk behandling forsøkes først, fulgt av kirurgi for dem som ikke oppnår tilstrekkelig smertelindring. Det er viktig at kirurgisk vurdering ikke utsettes unødvendig av gjentatte endoskopiske prosedyrer, noe som reduserer suksessraten ved kirurgi.
Obstruksjon av gallegang
Inflammasjon og fibrose i caput av pankreas kan skade gallegang og føre til benigne strikturer og kolestase. Slike strikturer kan være krevende å behandle. Det er viktig med god bildediagnostikk i forkant av terapi for å utelukke malign striktur, noe som kan være vanskelig på grunn av de inflammatoriske/fibrotiske forandringene sekundært til kronisk pankreatitt. Det er svært viktig at man ikke intervenerer endoskopisk dersom usikkerhet om malign etiologi men henviser til senter med HPB kirurg og MDT vurdering. Standard behandling av benigne strikturer har vært ERCP med gjentatte dilatasjoner og innleggelse av multiple plaststenter i gallegang over en periode på ett år (Fig 5). De senere år har bruk av selvekspanderende metallstent i 6-12 mnd. blitt mer vanlig dersom forholdene teknisk ligger til rette for dette. Det er imidlertid risiko for residiv av striktur på grunn av progresjon av grunntilstanden så gjentatt endoskopisk behandling kan bli nødvendig.
Fig 5: Pasient med gallegangsstriktur sekundært til kronisk pankreatitt som behandles med endoskopisk ballong dilatasjon og stenting av gallegang.
Pseudocyster
Pseudocyster oppstår oftest i senfasen av akutt pankreatitt (se over) men kan også sees ved kronisk pankreatitt. Mange pseudocyster gir ingen symptomer og oppdages tilfeldig under bildediagnostiske undersøkelser. Intervensjon er som ved akutt pankreatitt kun aktuelt dersom klinikk tilsier dette: smerter, avklemming av nærliggende organer (magesekk, duodenum, gallegang) eller om cysten skulle bli infisert. EUS veiledet transmural drenasje er første valg ved behov for intervensjon.
Gastrisk utløpsobstruksjon (Gastric outlet syndrome)
astrisk utløpsobstruksjon med ventrikkelretensjon er svært plagsomt for pasienten og kan ha en rekke årsaker, både benigne og maligne. I dag er maligne tilstander, spesielt kreft i pankreas, den vanligste årsaken til behandlingstrengende mekanisk obstruksjon, men både akutt og kronisk pankreatitt kan føre til gastrisk utløpsobstruksjon. Årsaken skyldes enten kompresjon av lumen (fra WON eller pseudocyster) eller inflammatorisk infiltrat og fibrose av duodenum. Kompresjon fra WON/pseudocyster behandles som beskrevet over. Fibrotiske stenoser er mer komplisert å behandle. Ballongdilatasjon har ofte begrenset og forbigående effekt og kan kompliseres av tarmperforasjon. Duodenalstent er også lite egnet på grunn av komplikasjonsrisiko ved langvarig stenting. Kirurgisk gastroenterostomi har lenge vært ansett som «gullstandarden» for behandling av ikke-reversible obstruksjoner, men også her har endoskopien gjort fremskritt. EUS veiledet gastroenterostomi ved hjelp av LAMS (Fig 6) har hovedsakelig vært brukt ved malign obstruksjon, men fremstår som et lovende minimalt invasivt alternativ også ved benigne strikturer. EUS veiledet gastroenterostomi gir rask symptomlindring og et kort sykehusopphold samtidig som den tilbyr en mer langvarig løsning enn luminal stenting og med lavere komplikasjonsrisiko enn kirurgi. Det er foreløpig ingen konsensus hvordan disse pasienten skal følges og behandles videre etter innleggelse av LAMS.
Gastriske varicer
Miltvenetrombose og utvikling av gastriske varicer kan også forekomme ved kronisk pankreatitt, men har lavere forekomst enn ved akutt pankreatitt. Blødningsrisiko og behandlingen er som beskrevet over.
Pankreascancer
Pasienter med kronisk pankreatitt har økt risiko (7 x normalbefolkningen) for adenocarcinom i pankreas. Mange symptomer på kronisk pankreatitt overlapper med symptomer på pankreascancer noe som kan gjøre det vanskelig å stille diagnosen tidlig. Man bør ha lav terskel for å vurdere malignitet ved nye eller endrede symptomer, som for eksempel forverring av smerter, uforklarlig vekttap eller ikterus. Det er viktig med god bildediagnostikk og kirurgisk vurdering før eventuell endoskopisk intervensjon vurderes.
Konklusjon
Endoskopisk behandling kan bli aktuelt i forløpet av både akutt alvorlig pankreatitt og kronisk pankreatitt. Ved akutt pankreatitt har særlig endoskopisk drenasje av infiserte nekroser fått mye oppmerksomhet og bidratt til et paradigmeskifte i behandlingen. Ved kronisk pankreatitt vil endoskopisk behandling først og fremst være aktuell i behandling av kroniske smerter. Endoskopiens stadig større betydning ved akutt alvorlig pankreatitt har ført til en diskusjon hvorvidt disse pasienten som tidligere stort sett ble behandlet av kirurger skal tilhøre medisin eller kirurgi. Ved kronisk pankreatitt er det kanskje motsatt; kirurgene må tidligere på banen enn det som har vært vanlig til nå. Pasientene håndteres imidlertid best i et team hvor både medisinere og kirurger med erfaring i vurdering og behandling av tilstandene er til stede. For kronisk pankreatitt er effekt av behandling avhengig av avholdenhet fra alkohol og tobakk, og det diskuteres i internasjonale fora i hvilken grad man kan kreve avholdenhet før man iverksetter kompliserte og meget ressurskrevende endoskopiske eller kirurgiske tiltak hos denne sammensatte og ofte krevende pasientgruppen.
Anbefalt litteratur
- Pankreatitt. Kirurgen 3-22, https://www.kirurgen.no/pdfarkiv/
- Diagnosis and Management of Acute Pancreatitis. Gastroenterology 2024
- Endoscopic management of acute necrotizing pancreatitis: European Society of Gastrointestinal Endoscopy (ESGE) evidence-based multidisciplinary guideline. Endoscopy 2018
- Chronic pancreatitis. Lancet 2024
- Endoscopic treatment of chronic pancreatitis: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 2018
- Long-term Outcomes of Early Surgery vs Endoscopy first in Chronic Pancreatitis. Follow-Up Analysis of the ESCAPE Randomized Clinical Trial. JAMA Surgery 2024
- American Society for Gastrointestinal Endoscopy guideline on the role of endoscopy in the management of chronic pancreatitis: summary and recommendations. Gastrointestinal Endoscopy 2024
- EUS før og nå. NGF nytt 2-24, https://gastroenterologen.no/pdf-arkiv/
- Visceral artery pseudoaneurysms in necrotizing pancreatitis: risk of early bleeding with lumen-apposing metal stents. Gastrointestinal Endoscopy 2022
- Management of the Disconnected Pancreatic Duct in Pancreatic Necrosis. Clinical Gastroenterology and Hepatology 2025
- Natural history of pancreatitis-induced splenic vein thrombosis: review and meta-analysis of its incidence and rate of gastrointestinal bleeding. HPB 2011
- Kronisk pankreatitt – utredning og behandling. Tidsskriftet 2018.